闫涛1,2 宋振纶2 Masoumeh Moradi2 杨丽景2 肖涛1,2 侯利锋1
1. 太原理工大学材料科学与工程学院太原030024;2. 中国科学院宁波材料技术与工程研究所中国科学院海洋新材料与应用技术重点实验室宁波315201
1 前言
金属材料浸泡在海水中,微生物会迅速附着,并在材料表面形成一层生物膜。这层生物膜将改变材料的表面状态及周围微环境,如溶氧量、离子浓度和pH值等,从而影响材料的腐蚀行为。通常微生物附着会加速金属构件的腐蚀,如厌氧的硫酸盐还原菌(SRB),在厌氧环境下,SRB将会大量繁殖并产生黏性物质加速金属的腐蚀。人们对此投入了大量的研究,并提出了SRB 加速腐蚀的多种机理[1,2]。近期,研究人员发现[3],部分微生物可以抑制碳钢、铝合金和铜合金等的腐蚀。微生物抑制金属腐蚀的机理主要有:微生物的呼吸作用会降低金属表面的氧浓度,从而减缓金属的腐蚀[4];微生物分泌产物胞外聚合物与金属离子耦合,在金属表面形成致密的生物膜,从而抑制金属的腐蚀[5]。此外,部分导电性固体材料表面形成的生物膜具有电活性,它们可以将培养基中的电子传递至材料表面,抑制腐蚀的进行[6]。同一种微生物往往可以抑制多种金属材料的腐蚀,相对于化学缓蚀剂,微生物防腐是一种高效及绿色环保的材料保护方法,因此一些学者提出使用再生生物膜来控制腐蚀的观点[7],并已在实验室将Al2024、碳钢和弹壳黄铜作为基体进行了研究。但是需要指出的是,生物膜的形成是一个复杂的生物和化学过程,其缓蚀作用往往是通过多种形式共同作用来实现的,因此在将生物膜作为抑制腐蚀性物质前,必须了解微生物抑制金属腐蚀的机理。
本课题组[8]在前期研究阶段分离出一种新的具有高度缓蚀作用的细菌,经鉴定属于新喀里多尼亚弧菌(Vibrio neocaledonicus),它可以在碳钢表面形成一层致密的生物膜,从而使其腐蚀速率降低60倍。为了进一步研究该微生物的缓蚀机理,本文选取Cu为研究对象,通过电化学方法和表面分析技术研究了新喀里多尼亚弧菌对Cu 在人工海水中腐蚀行为的影响,并讨论了该细菌对Cu的腐蚀抑制作用机理。
2 实验方法
2.1 实验材料
实验中所用材料分为纯Cu 和镀铜硅片两种。其中,镀铜硅片采用物理气相沉积法(PVD) 制备,Cu 薄膜厚度为6 μm,用来观察细菌的吸附及生物膜的形成过程。纯Cu 样品经水砂纸逐级打磨至2000#后抛光,丙酮脱脂后用蒸馏水清洗,然后在无水乙醇中超声清洗5 min,用N2吹干备用。实验前将样品浸泡在无水乙醇中,紫外照射灭菌30 min。
2.2 菌种来源及培养
实验所用菌种来源于东海海域,是一种好氧型细菌。采用Axygen 基因组DNA提取试剂盒提取纯化培养获得的细菌DNA。利用引物27F和1492R扩增16sRNA 基因序列全长,PCR 产物连接转化测得序列全长,然后通过细菌模式种网站对比,发现该菌种与Vibrio neocaledonicus (NC470(T)) 相似度最高,达到99.72%,因此,判断该细菌为Vibrio neocaledonicussp.。
使用修正过的2216e 培养基对细菌进行好氧富集培养。培养基成分为人工海水1 L,鱼粉蛋白胨3 g,琼脂20 g。人工海水的成分(g/L) 为:NaCl 23.476,Na2SO4 3.917,KCl 0.667,KBr 0.096,MgCl2·6H2O10.61,CaCl2·6H2O 1.469,H3BO3 0.026 和NaHCO30.192。将该菌种均匀的涂抹在灭菌后的新鲜培养基中,4 ℃保存于冰箱中备用。使用时先将细菌接种在新鲜的培养基中,放置在30 ℃恒温培养箱中培养1 d,之后按一定比例接种到实验溶液中,即为有菌介质。实验溶液中不含琼脂,其余成分与培养基一致。实验前将实验溶液及实验器材用压力蒸汽灭菌器在120 ℃下高温灭菌15 min,冷却后紫外照射灭菌30 min。
本实验采用比浊法测定细菌的生长曲线,利用紫外分光光度计(Lambda 950) 测定有菌介质中的光密度(O.D.) 值来推知菌液的浓度,将所测得的O.D.值与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,本实验选择的波长为600 nm。
2.3 失重实验
试样分别浸泡在无菌介质和有菌介质中密封好,放置在恒温培养箱中培养2,5 和10 d。浸泡前称重,浸泡结束后先用去离子水冲洗,然后放在10% (质量分数) H2SO4溶液中浸泡3 min 以除掉Cu表面的腐蚀产物,酒精冲洗,吹干后称重。
2.4 电化学测试
电化学阻抗谱和极化曲线测试在电化学工作站(PGSTAT302,Autolab) 上进行,采用三电极体系,辅助电极为Pt 电极,参比电极为饱和KCl 甘汞电极(SCE),工作电极为Cu,电极暴露面积为3.125 cm2,非工作面用环氧树脂封装。测试前,将Pt 电极、Cu 电极及盐桥浸泡在无水酒精中,紫外照射灭菌30 min。电化学阻抗谱(EIS) 测试扰动电位幅值为±10 mV,测试频率范围为10-2~105 Hz,极化测试扫描范围为相对开路电位±500 mV,扫描速率为2 mV/s。电化学实验时,在300 mL细口瓶中加入150 mL灭菌的2216e 液体培养液,然后接种过夜培养的新喀里多尼亚弧菌作为有菌介质,无菌介质为灭菌的2216e 培养液,通过定期更换灭菌培养液来保持无菌环境。将Cu试样浸泡在实验溶液中密封好,放置在30 ℃恒温震荡培养箱中培养,定期进行电化学测试。
2.5 细菌的吸附及生物膜的组成分析
利用激光共聚焦显微镜(LeiCa TCS SP5) 观察Cu 表面的细菌吸附情况。将浸泡在有菌介质中的Cu 片取出后,用3 mL/L 荧光染色剂SYT09 对Cu 表面进行染色处理(SYT09 可以穿透细胞壁与DNA结合发出蓝色荧光),避光静置20 min 后,用超净水将Cu表面的染色剂冲洗掉,放置在空气中干燥后用于激光共聚焦显微镜(CLSM) 观察。
将浸泡在无菌介质中的试样取出后,依次用浓度为50%,70%,90%和100%的乙醇脱水15min,然后用N2 吹干,表面喷金,利用扫描电子显微镜(SEM,Quanta FEG 250) 观察样品表面形貌。样品表面元素含量可用自带的能谱仪(EDS) 进行分析。有菌介质中浸泡的试样,取出后先放在戊二醛中硬化2 h,然后经脱水、干燥、喷金后用于SEM观察及EDS分析。
3 结果与讨论
3.1 细菌生长曲线

图1 为细菌在培养液中的生长曲线。纵坐标为O.D.值,反映了溶液中细菌的数量,O.D.值越大说明细菌浓度越高。可以看出,细菌数量在前24 h 迅速增长,由于开始培养液中的营养丰富,细菌生长繁殖不受底物的限制,此时细菌处于对数生长期。24 h浸泡后,细菌数量维持在一个相对恒定的阶段,处于稳定生长期,直到96 h,依然没有进入衰落期。为了使培养液中细菌一直处于生命活跃状态且数量大致恒定,选择每72 h 更换1/3的培养液。
3.2 失重实验
Cu的腐蚀速率按下式计算:
V = (W -W0)/ST(1)
其中,V 为腐蚀速率(g/(m2·h));W0为试样浸泡前的质量(g);W为浸泡后的质量(g);S 为试样面积(m2);T 为浸泡时间(h)。此外,可以用生物膜保护效率η来表征细菌的缓蚀作用:
η = Vbacteria/Vsterile(2)
式中,Vbacteria为试样浸泡在有菌介质中的腐蚀速率,Vsterile为试样浸泡在无菌介质中的腐蚀速率。η<1,表明微生物会抑制材料的腐蚀;η>1,表明此时微生物会促进腐蚀[9]。Cu浸泡在有菌介质和无菌介质中的失重数据见表1。

由表1 可知,在无菌环境中,Cu的腐蚀速率随浸泡时间延长而增大,原因是在溶液中有害离子的侵蚀下,Cu 表面初始形成的钝化膜逐渐被破坏,使Cu的腐蚀速率变大。在有菌介质中,浸泡2,5 和10 d后,η<1,说明微生物对基体具有保护作用。同时还发现,在有菌介质中,Cu在浸泡前后质量变化不大,说明在细菌的保护作用下,Cu表面几乎没有腐蚀。
3.3 电化学测试

3.3.1 开路电位 Cu 电极在无菌介质和有菌介质中开路电位随时间的变化曲线如图2 所示。可见,在无菌介质中,Cu 的开路电位变化较为平稳。在有菌介质中,经过短暂的平稳期,Cu 的开路电位即发生了较大程度的负移,浸泡1 d 后负移390 mV;在浸泡后期,稳定在-0.7 V附近。Cu 电极开路电位的负移是因为微生物的吸附和新陈代谢活动改变了Cu表面的电化学性质。吸附在Cu表面的细菌通过呼吸作用消耗金属表面的溶解氧,从而导致Cu的开路电路负移[10],1 d 后,Cu表面吸附的细菌数量饱和,使Cu的开路电位稳定在约-0.7 V。
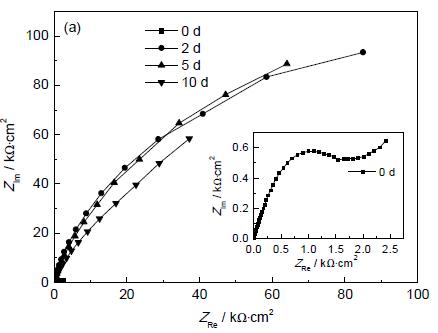
3.3.2 电化学阻抗谱 图3 和4 分别为Cu 在有/无菌介质中的EIS 测试结果。从图3a 中可看出,在有菌介质中,Cu从浸泡开始到第5 d,其容抗弧直径急剧增大;浸泡至第10 d,Cu 的容抗弧直径有所降低,但仍远大于浸泡初始(0 d) 的容抗弧直径。从Bode 图中可以看出,Cu 从浸泡开始,其低频区的阻抗模值|Z |及相位角急剧增大,到第5 d,达到最大值,之后略有降低。在无菌介质中,Cu 的容抗弧直径、低频区的阻抗模值|Z |及其相位角在浸泡初期均缓慢增大,之后有所降低。



根据Cu电极的EIS 特征,选择图5a 所示等效电路对Cu 电极在浸泡前及浸泡在无菌介质中的EIS进行拟合,选择图5b 对Cu浸泡在有菌介质中的EIS进行拟合。其中,Rs表示溶液电阻,Qdl为电极表面双电层电容,Rct表示电极表面电荷传递电阻,Rf为电极表面的膜电阻,Qf为电极表面膜电容。各参数拟合结果列于表2 中,其中,Y01为膜电容,Y02为双电层电容。

图5 Cu在浸泡前和浸泡在无菌介质中及浸泡在有菌溶液中的等效电路图
Fig.5 Equivalent circuit models of copper immersed in the solutions without (a) and with (b) bacteria

从表2 可以看出来,Cu试样浸泡在无菌介质中,其Rct 随浸泡时间的延长而缓慢增大,最后有所降低。这说明在浸泡初期,Cu表面初始形成的钝化膜具有一定的保护作用,减缓了Cu 的腐蚀;在浸泡后期,由于有害离子的侵蚀,钝化膜逐渐被破坏,其保护作用消失,Cu 的腐蚀速率变大。在有菌介质中,Cu电极从浸泡开始到第5 d,其Rct由初始的0.86 kΩ·cm2增大到第5 d的276.2 kΩ·cm2,约为初始值的321倍;到第10 d,Rct降低为117 kΩ·cm2,但依然远大于初始值,且远大于同期下Cu在无菌介质中的表面电荷传递电阻,说明该细菌可以强烈抑制Cu 的腐蚀,并且这种抑制作用经历了一个先增强后减弱的过程。
3.3.3 动电位极化曲线测试 图6 是Cu 浸泡在无菌和有菌介质中不同时间后的动电位极化曲线。在无菌介质中,Cu 的腐蚀电流密度变化不大,在浸泡后期,自腐蚀电位负移,说明Cu 的耐蚀性变差。Cu 在有菌介质中浸泡过程中,浸泡初期,其腐蚀电流密度迅速降低,在第2 d 达到最小值;随着浸泡时间的延长,Cu的腐蚀电流密度开始上升,但是,实验结束时Cu 的腐蚀电流密度仍然小于同期下浸泡在无菌介质中的,说明新喀里多尼亚弧菌能抑制Cu 的腐蚀。这一结果与EIS 结果一致。同时还发现,细菌的加入会使Cu 的自腐蚀电位降低,说明细菌的加入抑制了阴极反应的进行[11]。

3.4 细菌的吸附及生物膜的形成
3.4.1 细菌的吸附 图7 为Cu 浸泡在有菌介质中1 和10 d 后的激光共聚焦显微镜图片。从图7a中可以看出,在有菌介质中浸泡1 d 后,Cu表面已基本覆满细菌,这会使Cu 的开路电位明显负移、阻抗值迅速增大,腐蚀电流密度明显降低。10 d 后,Cu表面吸附的细菌已经聚集并形成菌落。

图7 纯Cu试样浸泡在有菌介质中1 和10 d 后的CLSM图
Fig.7 CLSM images of copper immersed in the solution with bacteria for 1 d (a) and 10 d (b)
3.4.2 表面形貌分析 图8 所示为Cu 分别在无菌介质(图8a) 和有菌介质(图8b) 中浸泡10 d 后的SEM像。可以看出,在无菌介质中,由于溶液中存在高浓度的有害离子,如Cl-和SO42-等,Cu腐蚀非常严重。在有菌介质中,Cu表面可见吸附的细菌及生物膜,并未见明显的腐蚀产物,Cu 表面状态变化不大,这一结果与失重实验结果一致。但是需要指出的是,Cu表面生物膜较少,而CLSM结果显示,Cu表面几乎被细菌所覆盖,这说明,Cu 表面吸附的细菌难以形成生物膜。原因可能是细菌与Cu 的吸附仅为可逆吸附,Cu表面的细菌处于吸附与脱附的动态平衡中,并不易形成生物膜。

图8 纯Cu试样分别浸泡在有菌介质和无菌介质中10 d后的SEM像
Fig.8 SEM images of copper after immersion in the solutions without (a) and with (b) bacteria for 10 d
3.4.3 生物膜的形成 图9 为镀铜硅片浸泡在有菌介质中不同时间后的SEM像。表3 是镀铜硅片分别在有菌和无菌介质中浸泡不同时间后的EDS结果。从图9a 中可以看出,镀铜硅片浸泡在有菌介质中后,细菌会附着到铜镀层缺陷处,原因是Cu 表面缺陷处容易腐蚀,易产生氢键,在van der waals力、静电作用力及氢键作用下,细菌倾向于吸附在Cu表面缺陷处。随着浸泡时间的延长,细菌胞外产物(EPS) 会黏附在Cu 表面[12]并形成一层由EPS、细菌及腐蚀产物组成的生物膜。从表3 中可知,相对于无菌环境,在有菌介质中浸泡后的Cu表面氧含量降低,说明细菌会减缓Cu 的腐蚀。同时还发现,在有菌环境下,Cu表面出现P,N和S 等元素,说明这3种元素均是生物源元素。在浸泡1 d 后,Cu 表面出现P,而此时Cu 表面吸附有大量的细菌,表明细菌中P 含量较高;在浸泡5d 后,Cu表面P 含量降低,说明生物膜中细菌数量减少,细菌从生物膜中脱附出去。从图9c 可以看出,细菌的脱附使金属表面生物膜变得不均匀,金属表面Cl-含量也增加,这些都会减弱微生物的缓蚀作用。

图9 镀铜硅片浸泡在有菌介质中不同时间的SEM像
Fig.9 SEM images of the Cu deposited Si wafer after immersion in the solution with bacteria for 1 d (a), 2 d (b) and 5 d (c)
3.5 新喀里多尼亚弧菌对Cu的腐蚀抑制机理

图10 细菌在Cu表面附着及生物膜的形成机理
Fig.10 Schematic illustrations of bacterial adhesion and biofilm formation on copper
如图10 中的模型所示,在浸泡初期,细菌大量吸附在Cu 的表面,这些细菌一方面会消耗Cu 表面溶解氧,另一方面作为阻碍层阻碍有害离子如Cl-向金属表面扩散,从而抑制Cu的腐蚀。由于受到细菌的保护,Cu表面溶解较为缓慢,几乎没有腐蚀,因而缺乏足够的活性中心,此时细菌的吸附多为可逆吸附[13],EPS 因为缺乏足够的配位离子而不会黏附在Cu 的表面。随着浸泡时间的增加,Cu 表面某些缺陷处被优先腐蚀,细菌及其分泌产物EPS 便会牢固吸附至腐蚀产物的表面,并进一步形成生物膜。在浸泡后期,Cu 表面氧含量降低,细菌会向氧含量较高的溶液中扩散,导致Cu 表面细菌吸附量减少,细菌的保护作用较弱。同时,由于Cu表面的生物膜并不均匀致密,容易形成氧浓差电池,这些将会降低细菌的缓蚀作用。
4 结论
(1) 新喀里多尼亚弧菌可以抑制Cu在人工海水中的腐蚀。在浸泡初期,细菌大量吸附至Cu 的表面,对基体起保护作用,从而抑制Cu的腐蚀。
(2) 随着浸泡时间的延长,Cu 表面的细菌逐渐向溶液中扩散,细菌的保护作用减弱,同时不均匀的生物膜会产生氧浓差电池,这些都会降低新喀里多尼亚弧菌的缓蚀作用。
参考文献
[1] Booth G H, Tiller A k. Cathodic characteristics of mild steel in suspensionsof sulphate- reducing bacteria [J]. Corros. Sci., 1968, 8:583
[2] Antony P, Chongdar S, Kumar P, et al. Corrosion of 2205 duplexstainless steel in chloride medium containing sulfate-reducing bacteria[J]. Electrochim. Acta, 2007, 52(12): 3985
[3] Nagiub A, Mansfeld F. Evaluation of microbiological influencedcorrosion inhibition using electrochemical noise analysis [J]. Corros.Sci., 2001, 43: 2001
[4] Jayaraman A, Cheng E T, Earthman J C, et al. Axenic aerobic biofilmsinhibit corrosion of SAE 1018 steel through oxygen depletion[J]. Appl. Microbiol. Biotechnol., 1997, 48: 11
[5] Masoumeh M. Effect of marine Pseudoalteromonas sp. on the microstructureand corrosion behavior of 2205 duplex stainless steel[J]. Corros. Sci., 2014, 84: 103
[6] Benjamin E, Narcis M D, Ghangrekar M M, et al. Application ofelectro-active biofilms [J]. Biofouling, 2010, 26(1): 57
[7] Jackson G, Beyenal H, Rces W M, et al. Growing reproducible biofilmswith respect to structure and viable cell counts [J]. J. Microbiol.Methods, 2001, 47: 1
[8] Masoumeh M. Introducing a novel bacterium, Vibrio neocaledonicussp., with the hignest corrosion inhibition efficiency [J]. Electrochem.Commun., 2015, 51: 64
[9] Liu H F, Xu L M, Zheng J S. Effect of biofilm on corrosion of carbonsteel [J]. J. Chin. Soc. Corros. Prot., 2000, 20(1): 41(刘宏芳, 许立铭, 郑家燊。 SRB 生物膜与碳钢腐蚀的关系[J]. 中国腐蚀与防护学报, 2000, 20(1): 41)
[10] Potekhina J S. Role of microorganisms in corrosion inhibition ofmetals in aquatic habitats [J]. Appl. Micriol. Biotechnol., 1999,52: 639
[11] Du X Q, Duan J Z, Hou B R. Corrosion behavior of 316L stainlesssteel influenced by iron- reducing bacteria shewanella algae biofilms[J]. J. Chin. Soc. Corros. Prot., 2013, 33(5): 363(杜向前, 段继周, 侯宝荣。 铁还原细菌Shewanella algae 生物膜对316L不锈钢腐蚀行为的影响[J]. 中国腐蚀与防护学报, 2013,33(5): 363)
[12] Kumari K. Characterisation and anti-biofilm activity of extracellularpolymeric substances from oceanobacillus iheyensis [J]. Carbohydr.Polym., 2014, 101: 29
[13] Valcaece M B. The influence of the surface condition on the adhensionof pseudomonas fluorescens (ATCC 17552) to copper and aluminiumbrass [J]. Int. Biodeterior. Biodegrad., 2002, 50: 61