氢去极化腐蚀与氧去极化腐蚀
2012-08-01 00:00:00
作者:林玉珍 来源:《腐蚀防护之友》
由图可见,氢过电位低的阴极相杂质,如Fe、cu,对腐蚀起促进作用,使金属腐蚀速度增大。而过电位高的杂志,如Hg,将会使基体金属腐蚀速度变低。
表面状态对氢过电位也有影响,粗糙表面与光滑表面相比,前者因实际面积大,电流密度小,氢过电位就小,氢去极仃腐蚀也就越严重。
(4)与阴极面积有关。
阴极区面积增加,氢过电位减小,析氢反应加快,导致腐蚀速度增大。从图2可见,由于碳钢中碳是以Fe3C的形式分散存在的,在Fe3C上的析氢过电位较低,所以碳钢比工业纯铁腐蚀严重。如果含碳量越高,则局部阴极(Fe3C)的面积就越大,阴极极化率就越小,腐蚀速度就越大。因此,碳钢在盐酸中的腐蚀速度随含碳量的增加而上升。
(5)与温度有关。
温度升高,氢过电位减小,阳极反应和阴极反应都将加快,从而使腐蚀速度加剧。
氧去极化腐蚀
在中性和碱性溶液中,氢离子浓度较小,析氢反应电位较低。因此,一般金属腐蚀过程的阴极反应往往不可能是析氢反应。而溶液中溶解氧的还原反应电位要比氢的电位正1.229V,所以,在这种情况下,往往是吸氧反应,氧分子将作为腐蚀的去极化剂。可见氧去极化腐蚀要比氢去极化腐蚀更为普遍。自然条件(大气、海水、土壤)下的腐蚀,大多是属于这一类。
氧向金属(电极)表面的输送
在腐蚀过程中,溶解氧不断在金属表面还原,大气中的氧就不断溶入溶液并向金属表面输送,其过程较为复杂。如图4所示
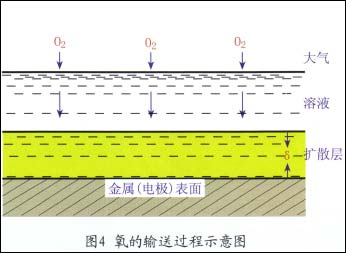
(1)氧通过空气/溶液界面溶入溶液中。
(2)以对流和扩散方式通过溶液本体的厚度层。
(3)以控散方式通过金属表面溶液的静止层而达到金属表面。
虽然扩散层厚度不大,一般为10-2~5×10-2,但氧只能以扩散这种唯一的方式通过。因此,通常扩散步骤最缓慢,导致此步成为整个阴极过程的控制步骤。
氧的还原反应及其阴极极化曲线
在酸性溶液中氧的还原反应为
02+4H++4e→2H20
在碱性溶液中氧的还原反应为
02+2H20+4e→4OH-
氧的还原反应历程较为复杂,至今尚待研究。氧气极化的阴极极化曲线,如图5所示。

由于控制因素不同,氧还原过程的总阴极极化曲线分为四个部分:
(1)阴极过程由氧的离子化反应速度所控制
如果氧的供应充足,且在不大的电流密度下进行时,就属于此种情况(见图中Ee,0PBC)
在一定的电流密度范围内,氧的过电与电流密度的对数成直线关系,并服从塔菲尔公式
η0=Ee,0一Ek=a0+b01gi
常数a0与电极材料与表面状态有关,常数b0与电极材料无关。
但实际上,当i>1/2id时,浓度极化会出现,极化曲线的走向将偏离Ee,0PBC。
阴极过程由氧的离子化反应和氧的扩散过程混合控制
当电流为1/2id<i>id(极限扩散电流密度)时,由于浓度极化的出现,曲线将从P点开始偏离BC线而走向F点。阴极过程的速度将与氧的离子化反应和氧的扩散过程都有关。
(3)阴极过程由氧的扩散过程控制
因扩散过程的阻滞,随电流密度增大,极化曲线开始很徒地上升,当i=id时,就形成垂直地走向FSN,电极电位大大地移向负方。此时整个阴极过程的速度完全由氧的扩散过程控制,氧去极化的过电位不再决定定于电极材料和表面状态,而是完全取决于氧的极限扩散电流密度id,即取决于氧的溶解度及氧在溶液中的扩散条件。
4/5 首页 上一页 2 3 4 5 下一页 尾页
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。